By समाजसेवी वनिता कासनियां पंजाबएल्युमिनियमBy समाजसेवी वनिता कासनियां पंजाबधात्विक रासायनिक तत्वकिसी अन्य भाषा में पढ़ेंडाउनलोड करेंध्यान रखेंसंपादित करेंएल्युमिनियम / Aluminiumरासायनिक तत्वAl,13.jpgनमूनारासायनिक चिन्ह: Alपरमाणु संख्या: 13रासायनिक शृंखला: संक्रमणोपरांत धातुAl-TableImage.svgआवर्त सारणी में स्थितिElectron shell 013 Aluminium.svgइलेक्ट्रॉनिक ढांचाअन्य भाषाओं में नाम: Aluminium (अंग्रेज़ी)एलुमिनियम एक रासायनिक तत्व है जो धातुरूप में पाया जाता है। यह भूपर्पटी में सबसे अधिक मात्रा में पाई जाने वाली धातु है। एलुमिनियम का एक प्रमुख अयस्क है - बॉक्साईट। यह मुख्य रूप से अलुमिनियम ऑक्साईड, आयरन आक्साईड तथा कुछ अन्य अशुद्धियों से मिलकर बना होता है। बेयर प्रक्रम द्वारा इन अशुद्धियों को दूर कर दिया जाता है जिससे सिर्फ़ अलुमिना (Al2O3) बच जाता है। एलुमिना से विद्युत अपघटन द्वारा शुद्ध एलुमिनियम प्राप्त होता है।एलुमिनियम धातु विद्युत तथा ऊष्मा का चालक तथा काफ़ी हल्की होती है। इसके कारण इसका उपयोग हवाई जहाज के पुर्जों को बनाने में किया जाता है। भारत में जम्मू कश्मीर, मुंबई, कोल्हापुर, जबलपुर, रांची, सोनभद्र, बालाघाट तथा कटनी में बॉक्साईट के विशाल भंडार पाए जाते है। उड़ीसा स्थित नाल्को (NALCO) दुनिया की सबसे सस्ती अलुमिनियम बनाने वाली कम्पनी है[1]।इतिहाससंपादित करेंऐल्यूमिनियम श्वेत रंग की एक धातु है। लैटिन भाषा के शब्द ऐल्यूमेन और अंग्रेजी के शब्द ऐलम का अर्थ फिटकरी है। इस फिटकरी में से जो धातु पृथक की जा सकी, उसका नाम ऐल्यूमिनियम पड़ा। फिटकिरी से तो हमारा परिचय बहुत पुराना है। कांक्षी, तुवरी और सौराष्ट्रज इसके पुराने नाम है। फिटकरी वस्तुत: पोटैसियम सल्फ़ेट और ऐल्यूमिनियम सल्फ़ेट इन दोनों का द्विगुण यौगिक है।सन् 1754 में मारग्राफ़ (Marggraf) ने यह प्रदर्शित किया कि जिस मिट्टी को ऐल्यूमिना कहा जाता है, वह चूने से भिन्न है। सर हंफ्री डेवी ने सन् 1807 ही में ऐल्यूमिया मिट्टी से धातु पृथक करने का प्रयत्न किया, परंतु सफलता न मिली। सन् 1825 में अर्स्टेड (Oersted) ने ऐल्युमिनियम क्लोराइड को पोटैसियम संरस के साथ गरम किया और फिर आसवन करके पारे को उड़ा दिया। ऐसा करने पर जो चूर्ण सा बच रहा उसमें धातु की चमक (धात्वाभा) थी। यही धातु ऐल्युमिनियम कहलाई। सन् 1845 में फ़्रेडरिक वोहलर (Frederik Wohler) ने इस धातु के तैयार करने में पोटैसियम धातु का प्रयोग अपचायक के रूप में किया। उसे इस धातु के कुछ छोटे-छोटे कण मिले, जिनकी परीक्षा करके उसने बताया कि यह नई धातु बहुत हल्की है (आपेक्षिक घनत्व 2.5-2.7) और इसके तार खींचे जा सकते हैं। तदनंतर सोडियम और सोडियम ऐल्यूमिनियम क्लोराइड का प्रयोग करके सन् 1854 में डेविल (Deville) ने इस धातु की अच्छी मात्रा तैयार की। उस समय नई धातु होने के कारण ऐल्यूमिनियम की गिनती बहुमूल्य धातुओं में की जाती थी और इसका उपयोग आभरणों और अलंकारों में होता था। सन् 1886 में ओहायो (अमरीका) नगर में चाल्र्स मार्टिन हॉल ने गले हुए क्रायोलाइट में ऐल्यूमिना घोला और उसमें से विद्युद्विश्लेषण विधि द्वारा ऐल्यूमिनियम धातु पृथक की। यूरोप में भी लगभग इसी वर्ष हेरो (Heroult) ने स्वतंत्र रूप से इसी प्रकार यह धातु तैयार की। यही हॉल-हेरो-विधि आजकल इस धातु के उत्पादन में व्यवहृत हो रही है। हलकी और सस्ती होने के कारण ऐल्यूमिनियम और उससे बनी मिश्र धातुओं का प्रचलन तब से बराबर बढ़ता चला जा रहा है।ऐल्यूमिनियम का निष्कर्षणसंपादित करेंऐल्यूमिनियम धातु तैयार करने के लिए दो खनिजों का विशेष उपयोग होता है। एक तो बौक्सॉइट (Al2 O3. 2H2O) और दूसरा क्रायोलाइट (3NaF. Al F3)। बौक्साइट के विस्तृत निक्षेप भारत में राँची, पलामू, जबलपुर, बालाघाट, सेलम, बेलगाम, कोल्हापुर, थाना आदि जिलों में पाए गए हैं। इस देश में इस खनिज की अनुमित मात्रा 2.8 करोड़ टन है।ऐल्यूमिनियम धातु तैयार करने के निर्मित्त पहला प्रयत्न यह किया जाता है कि बौक्साइट से शुद्ध ऐल्यूमिना मिले। बौक्साइट के शोधन की एक विधि, बायर (Baeyer) विधि के नाम पर प्रचलित है। इसमें बौक्साइट को गरम कास्टिक सोडा के विलयन के साथ आभिकृत करके सोडियम ऐल्यूमिनेट बना लेते हैं। इस ऐल्यूमिनेट के विलयन को छान लेते हैं और इसमें से फिर ऐल्यूमिना का अवक्षेपण कर लिया जाता है। (अवक्षेपण के निर्मित विलयन में ऐल्यूमिना ट्राइहाइड्रेट के बीजों का वपन कर दिया जाता है, जिससे सब ऐल्यूमिना अवक्षेपित हो जाता है)।ऐल्यूमिना से ऐल्यूमिनियम धातु हॉल-हेरो-विधि द्वारा तैयार की जाती है। विद्युद्विश्लेषण के लिए जिस सेल का प्रयोग किया जाता है वह इस्पात का बना एक बड़ा बक्सा होता है, जिसके भीतर कार्बन का अस्तर लगा रहता है। कार्बन का यह अस्तर कोक, पिच और तारकोल के मिश्रण को तपाकर तैयार किया जाता है। इसी प्रकार कार्बन के धनाग्र भी तैयार किए जाते हैं। ये बहुधा 12-20 इंच लंबे आयताकार होते हैं। ये धनाग्र एक संवाहक दंड (बस बार) से लटकते रहते हैं और इच्छानुसार ऊपर नीचे किए जा सकते हैं। विद्युत् सेल के भीतर गला हुआ क्रायोलाइट लेते हैं और विद्युद्धारा इस प्रकार नियंत्रित करते रहते हैं कि उसके प्रवाह की गरमी से ही क्रायोलाइट बराबर गलित अवस्था में बना रहे। विद्युद्विश्लेषण होने पर जो ऐल्यूमिनियम धातु बनती है वह क्रायोलाइट से भारी होती है, अत: सेल में नीचे बैठ जाती है। यह धातु ही ऋणाग्र का काम करती है। गली हुई धातु समय-समय पर सेल में से बाहर बहा ली जाती है। सेल में बीच-बीच में आवश्यकतानुसार और ऐल्यूमिना मिलाते जाते हैं। क्रायोलाइट के गलनांक को कम करने के लिए इसमें बहुधा थोड़ा सा कैल्सियम फ़्लोराइड भी मिला देते हैं। यह उल्लेखनीय है कि ऐल्यूमिनियम धातु के कारखाने की सफलता सस्ती बिजली के ऊपर निर्भर है। 20,000 से 50,000 ऐंपीयर तक की धारा का उपयोग व्यापारिक विधियों में किया जाता रहा है।एलुमिनियम के गुणसंपादित करेंव्यवहार में काम आनेवाली धातु में 99% 99.3% ऐल्यूमिनियम होता है। शुद्ध धातु का रंग श्वेत होता है, पर बाजार में बिकनेवाले ऐल्यूमिनियम में कुछ लोह और सिलिकन मिला होने के कारण हलकी सी नीली आभा होती है।भौतिक गुणसंपादित करेंपरमाणुभार : 26.97आपेक्षिक उष्मा (20रू सें. पर) : 0.214आपेक्षिक उष्मा चालकता (कलरी प्रति सें.मी. घन, प्रति डिग्री सें., प्रति सैकंड, 18डिग्री सें. पर) : 0.504गलनांक (99.97% शुद्धता) : 659.8रूक्वथनांक : 1800 डिग्रीगलन की गुप्त उष्मा : 95.3आपेक्षिक घनत्व : 2.703गलनांक पर द्रव का घनत्व : 2.382विद्युत् प्रतिरोध, 20 डिग्री सें. पर : 2.845 (माइक्रोम प्रति सें.मी.घन)विद्युत् रासायनिक तुल्यांक : 0.00009316 ग्राम प्रति कूलंबपरावर्तनता (श्वेत प्रकाश के लिए) : 85%ठोस होने पर संकोच : 6.6%विद्युदग्र विभव (विलयन में 25 डिग्री पर) 1.69 वोल्टरासायनिक गुणसंपादित करेंऐल्यूमिनियम पर साधारण ताप पर ऑक्सिजन का कुछ भी प्रभाव नहीं पड़ता, परंतु यदि धातु के चूर्ण को 400 डिग्री ताप पर ऑक्सिजन के संपर्क में लाया जाए, तो पर्याप्त अपचयन होता है। अति शुद्ध धातु पर पानी का भी प्रभाव नहीं पड़ता, पर ताँबा, पीतल अथवा अन्य धातुओं की समुपस्थिति में पानी का प्रभाव भी पर्याप्त होता है। कार्बन अथवा कार्बन के ऑक्साइड ऊँचे ताप पर धातु को कार्बाइड (Al4 C3) में परिणत कर देते हैं। पारा और नमी की विद्यमानता में धातु हाइड्राक्साइड बन जाती है। यदि ऐल्यूमिनियम चूर्ण और सोडियम पराक्साइड के मिश्रण पर पानी की कुछ ही बूँदें पड़ें, तो जोर का विस्फोट होगा। ऐल्यूमिनियम चूर्ण और पोटैसियम परमैंगनेट का मिश्रण जलते समय प्रचंड दीप्ति देता है। धातु का चूर्ण गरम करने पर हैलोजन और नाइट्रोजन के साथ भी जलने लगता है और ऐल्यूमिनियम हैलाइड और नाइट्राइड बनते हैं। शुष्क ईथर में बने ब्रोमीन और आयोडीन के विलयन के साथ भी यह धातु उग्रता से अभिक्रिया करके ब्रोमाइड और आयोडाइड बनाती है। गंधक, सेलीनियम और टेल्यूरियम गरम किए जाने पर ही इस धातु के साथ संयुक्त होते हैं। हाइड्रोक्लोरिक अम्ल गरम होने पर धातु के साथ अभिक्रिया करके क्लोराइड बनाता है। यह क्रिया धातु की शुद्धता और अम्ल की सांद्रता पर निर्भर है। तनु सल्फ़्यूरिक अम्ल का धातु पर धीरे-धीरे ही प्रभाव पड़ता है, पर अम्ल की सांद्रता बढ़ाने पर यह प्रभाव पहले तो बढ़ता है, पर फिर कम होने लगता है। 98% सल्फ़्यूरिक अम्ल का धातु पर बहुत ही कम प्रभाव पड़ता है। नाइट्रिक अम्ल का प्रभाव इस धातु पर इतना कम होता है कि सांद्र नाइट्रिक अम्ल ऐल्यूमिनियम के बने पात्रों में बंद करके दूर-दूर तक भेजा जा सकता है। अमोनिया का विलयन कम ताप पर तो धातु पर प्रभाव नहीं डालता, परंतु गरम करने पर अभिक्रिया तीव्रता से होती है। कास्टिक सोडा, कास्टिक पोटाश और बेराइटा का ऐल्यूमिनियम धातु पर प्रभाव तीव्रता से होता है, परंतु कैल्सियम हाइड्राक्साइड का अधिक नहीं होता।ऐल्यूमिनियम ऑक्सिजन के प्रति अधिक क्रियाशील है। इस गुण के कारण अनेक आक्साइडों के अपचयन में इस धातु का प्रयोग किया जाता है। गोल्डश्मिट की थर्माइट या तापन विधि में ऐल्यूमिनियम चूर्ण का प्रयोग करके लौह, मैंगनीज़, क्रोमियम, मालिबडीनम, टंग्सटन आदि धातुएँ अपने आक्साइडों में से पृथक की जाती हैं।ऐल्यूमिनियम को संक्षारण से बचानासंपादित करेंबेंगफ (Bengough) और सटन ने 1926 ई. में एक विधि निकाली जिसके द्वारा ऐल्यूमिनियम धातु पर उसके आक्साइड का एक पटल इस दृढ़ता से बन जाता है कि उसके नीचे की धातु संक्षारण से बची रहे। यह कार्य विद्युद्धारा की सहायता से किया जाता है। ऐल्यूमिनियम पात्र को धनाग्र बनाकर 3 प्रतिशत क्रोमिक अम्ल के विलयन में (जो यथासंभव सल्फ़्यूरिक अम्ल से मुक्त हो) रखते हैं। वोल्टता धीरे-धीरे 40 वोल्ट तक 15 मिनट के भीतर बढ़ा दी जाती है। 35 मिनट तक इसी वोल्टता पर क्रिया होने देते हैं, फिर वोल्टता 5 मिनट के भीतर 50 वोल्ट कर देते हैं और 5 मिनट तक इसे स्थिर रखते हैं। ऐसा करने पर पात्र पर आक्साइड का एक सूक्ष्म पटल जम जाता है। पात्र पर रंग या वार्निश भी चढ़ाई जा सकती है और यथेष्ट अनेक रंग भी दिए जा सकते हैं। इस विधि को एनोडाइज़िंग या धनाग्रीकरण कहते हैं और इस विधि द्वारा बनाए गए सुंदर रंगों से अलंकृत ऐल्यूमिनियम पात्र बाजार में बहुत बिकने को आते हैं।ऐल्यूमिनियम मिश्रधातुएँसंपादित करेंऐल्यूमिनियम लगभग सभी धातुओं के साथ संयुक्त होकर मिश्र धातुएँ बनाता है, जिनमें से तॉबा, लोहा, जस्ता, मैंगनीज़, मैगनीशियम, निकेल, क्रोमियम, सीसा, बिसमथ और वैनेडियम मुख्य हैं। ये मिश्रधातुएँ दो प्रकार के काम की हैं – पिटवाँ और ढलवाँ। पिटवाँ मिश्रधातुओं से प्लेट, छड़ें आदि तैयार की जाती हैं। इनकी भी दो जातियाँ हैं, एक तो वे जो बिना गरम किए ही पीटकर यथेच्छ अवस्था में लाई जा सकती हैं, दूसरी वे जिन्हें गरम करना पड़ता है। पिटवाँ और ढलवाँ मिश्रधातुओं के दो नमूने यहाँ दिए जाते हैं-ढलवाँ : ताँबा 8%, लोहा 1%, सिलिकन 1.2%, ऐल्यूमिनियम 89.8% पिटवाँ : ताँबा 0.9%, सिलिकन 12.5%, मैगनीशियम 1.0 %, निकेल 0.9%, ऐल्यूमिनियम 84.7%ऐल्यूमिनियम के यौगिकसंपादित करेंऐल्यूमिनियम ऑक्साइड (Al2 O3) प्रकृति में भी पाया जाता है तथा फिटकरी और अमोनिया क्षार की अभिक्रिया से तैयार भी किया जा सकता है। इसमें जल की मात्रा संयुक्त रहती है। जलरहित ऐल्यूमिनियम क्लोराइड (AlCl3) का उपयोग कार्बनिक रसायन की फ़्रीडेन-क्राफ़्ट अभिक्रिया में अनेक संश्लेषणों में किया जाता है। ऐल्यूमिनियम सलफ़ेट के साथ अनेक फिटकरियाँ बनती हैं। धातु को नाइट्रोजन या अमोनिया के साथ 800 डिग्री से. ताप पर गरम करके ऐल्यूमिनियम नाइट्राइड, (AlN), तैयार किया जा सकता है। सरपेक (Serpek) विधि में ऐल्यूमिना और कार्बन को नाइट्रोजन के प्रवाह में गरम करके यह नाइट्राइड तैयार करते थे। इस प्रकार वायु के नाइट्रोजन का स्थिरीकरण संभव था। बौक्साइट और कार्बन को बिजली की भट्टियों में गलाकर ऐल्यूमिनियम कार्बाइड (Al4 C3) तैयार करते हैं, जो संक्षारण से बचाने में बहुत काम आता है और ऊँचा ताप सहन कर सकता है।ऐल्युमिनियम त्रिसंयोजी तत्व है अत: इसके यौगिकों में +3 की संयोजकता, Al(III), प्रदर्शित होती है। इसके प्रमुख यौगिक आक्साइड, क्लोराइड, नाइट्रेट, सल्फेट तथा हाइड्राक्साइड हैं।ऐल्युमिनियम आक्साइड (Al2O3)- इसे ऐल्युमिना भी कहते हैं। यह ऐल्युमिनियम का श्वेत या रंगहीन आक्साइड है जो दो रूपों में पाया जाता है-स्थायी रूप अथवा अ-रूप जिसके क्रिस्टल षटभुजी होते हैं तथा गामा ऐल्युमिना (य्) जो गर्म करने पर अ-रूप में बदल जाता है। इनके अतिरिक्त भ्.8 आदि रूप भी ज्ञात हैं जिनमें क्षारीय धातु आयन रहते हैं।ऐल्युमिना प्रकृति में बाक्साइट तथा कोरंडम के रूप में पाया जाता है। इसे ऐल्युमिनियम हाइड्राक्साइड, नाइट्रेट अथवा अमोनियम फिटकरी को गर्म करके प्राप्त किया जा सकता है।2 Al (OH)3 --> Al2O3+3H2O4 Al (NO3)2 --> Al2O3+ 8NO2+3O2(NH4)2 SO4.Al2(SO4)3 --> Al2O3+4SO3+2NH3-H2Oशुद्ध ऐल्युमिनियम आक्साइड प्राप्त करने के लिए बाक्साइट अयस्क को सोडियम हाइड्राक्साइड में घोलते हैं। जो अशुद्धियाँ होती हैं वे अविलेय रही आती हैं। ऐल्युमिनियम हाइड्राक्साइड अवक्षेप को विलग करके 1150-1200 तक गर्म करने पर अ_ आक्साइड बनाता है। यह अत्यधिक कठोर पदार्थ है अत: अपघर्षक के रूप में प्रयुक्त किया जाता है। इसकी अग्निसह ईंटें भी बनाई जाती हैं। भट्टियों में दुर्गलनीय अस्तर बनाने के भी काम आता है।ऐल्युमिनियम आक्साइड उभयधर्मी है अत: अम्लो तथा क्षारों में समान रूप से विलयित होकर लवण उत्पन्न करता है। क्षारों के साथ ऐल्युमिनेट बनता है।Al2O3+6HCl --> 2AlCl3-3H2OAl2O3+2NaOH-2NaAlO2+H2Oहाइड्रोजन अथवा कार्बन के साथ गर्म करने पर Al2O3 अपचित नहीं होता.ऐल्युमिनियम ऐसीटेट अथवा ऐथेनोएट- यह श्वेत ठोस है जो ठंडे जलमें बहुत कम विलेय है और गर्म जल में विघटित हो जाता है। जल की अनुपस्थित में शुद्ध लवण बन सकता है। अन्यथा क्षारीय लवण ही बनता है। इसका उपयोग रंगबन्धक के रूपमें तथा टैंनिग में किया जाता है। पहले संक्रमणरोधी तथा औषधि के रूप में प्रयुक्त होता था।ऐल्युमिनियम क्लोराइड (AlCl3)- यह श्वेत ठोस है और जल के साथ तीव्रता से क्रिया करके HCl बनाता है। यह दो रूपों में पाया जाता है- (1) निर्जल रूप तथा (2) जलयोजित हेक्साहाइड्रेट AlHCl3.6H2O. प्रयोगशाला में ऐल्युमिनियम के ऊपर क्लोरीन गैस प्रवाहित करके निजल क्लोराइड प्राप्त करते हैं-2Al +3HCl2 -2AlHCl3किन्तु बहुत मात्रा में उत्पादक के लिए गरम किये गये ऐल्युमिना तथा कार्बन मिश्रण के ऊपर क्लोरीन प्रवाहित करते हैं-जलयोजित क्लोराइड प्राप्त करने के लिए ऐल्युमिनियम धातु या ऐल्युमिना को हाइड्रोक्लोरिक अम्ल में विलयित करके विलयन को सुखाकर किया जाता है-2Al+6H --> HCl + H2यदि जलयोजित क्लोराइड को गर्म करके निर्जल लवण बनाना चाहें तो यह सम्भव नहीं है क्योंकि तब ऐल्युमिना बनता है-2 AlHCl3. 6H2O --> Al2O H2O + 6HHClद्रव तथा वाष्प अवस्था में समान रूप Al2HCl6 पाया जाता है। ऐल्युमिनियक्लोराइड का जल अपघटन होता है अत: HHCl डालकर रखना चाहिए. इसका उपयोग तेलों के भंडारों में उत्प्रेरक के रूप में होता है। फ्रीडल-क्रैफ्ट अभिक्रियां भी उत्प्रेरक का कार्य करती हैं।ऐल्युमिनियम ट्राइमेथिल (Al3H2O3) यह रंगहीन द्रव्य है जो वायु में जल उठता है और जल के साथ अभिक्रिया करके मेथेन तथा Al(OH)3 बनाता है। इसे AlHCl3 के साथ ग्रिग्न्याँ अभिकर्मक की क्रिया द्वारा तैयार करते हैं। इसका उपयोग उच्च घनत्व वाले पालीथीन बनाने में होता है।ऐल्युमिनियम नाइट्रेट Al(NO)3 यह श्वेत ठोस है। इस तुरन्त अवक्षेपित Al(OH)3 में से HNO3 की क्रिया कराकर या फिर Al2(SO4)3 एवं (NO3)2 विलयनों को मिलाकर PbSO4 अवक्षेप को छानकर प्राप्त कर सकते हैं। इसका उपयोग रँगाई तथा गैस गैटल बनाने में होता है।ऐल्युमिनियम पोटैसियम सल्फेट Al2(SO4)3.K2SO4. 24 H2O- यह पोटाश ऐलम या ऐलग (फिटकरी) के नाम से प्रसिद्ध है। यह श्वेत क्रिस्टलीय यौगिक है जिसे गर्म करने पर पहले 18 H2O निकल जाता है और अधिक गर्म करने पर (200) निर्जल बन जाता है। यह गर्म जल में विलेय है किन्तु एथेनाल तथा ऐसीटोन में अविलेय है। इसे तैयार करने के लिए पोटैसियम सल्फेट तथा ऐल्युमिनियम सल्फेट की समआणविक मात्राएँ विलयन रूप में मिलाई जाती है। इसका उपयोग रंगबन्धक, चमड़ा कमाने तथा अग्निशामक में होता है।ऐल्युमिनियम फ्लोराइड AlF- यह रंगहीन यौगिक है जिसे Al (OH)2 के ऊपर HF की क्रिया कराकर बनाते हैं। इस पर अम्लों या क्षारों की कोई क्रिया नहीं होती.ऐल्युमिनियम सल्फेट- यह निर्जल तथा जलयोजित रूपों में प्राप्त होता है। Al2(SO4)3 निर्जल रूप है जो श्वेत क्रिस्टलीय यौगिक है। जलयोजित यौगिक Al2(SO4) 18 H2O है जो 86.5 पर अपना जल खो देता है। जलयोजित तथा निर्जल दोनों ही रूप में जल विलेय हैं। जब Al(OH)3 के साथ H2SO4 की क्रिया कराई जाती है या चीनी मिट्टी (केओलिन) या बाक्साइट पर H2SO4 की क्रिया कराते हैं जो जलयोजित सल्फेट बनता है। इसका जलीय विलयन अम्लीय होता है-Al2 (SO4)3 + 6H2O --> 2Al(OH)3 + 3H2SO4 यह क्षारीय धातु सल्फेटों के साथ फिटकरी बनाता है। गर्म करने पर इसका अपघटन हो जाता है-Al2(SO4)3 --> Al2O3 +3SOइसका उपयोग पानी के शोधन, विशेषतया मल-जल के परिष्कार, कपड़ो की रँगाई, चमड़े की रँगाई तथा कागज उद्योग में होता है। इससे अग्निसह पदार्थ बनाये जाते है।ऐल्युमिनियम सिलेकेट- प्राकृतिक तथा सश्लिष्ट दोनों प्रकार के यौगिक, जिनमें Al.Si के साथ आक्सीजन संयुक्त रहता है। मृत्तिकाएँ, जेयोलाइट, अभ्रक आदि मुख्य उदाहरण हैं।ऐल्युमिनियम हाइड्राक्साइड Al(OH)3- यह उभयधर्मी हाइड्राक्साइड है जो अम्लों तथा क्षारों में समान रूप सें विलयित हो जाता है। यह श्वेत जिलेटिनी ठोस है जिसे ऐल्युमिनियम लवणों के विलयन में अमो_निया डालकर तैयार किया जा सकता है। यह गर्म किये जाने पर ऐल्युमिना में परिणत हो जाता है।2Al(OH)3 --> Al2O3 + 3H2Oइसमें उपसहसंयोजित जल अणु होते हैं अत: जलयोजित Al(OH)3 कहलाता है। इसका उपयोग जल परिष्करण, रंगबंधक तथा जलसह वस्त्र बनाने में होता है। उत्प्रेरक तथा क्रोमैटोग्राफी में भी प्रयुक्त.चित्रसंपादित करेंAluminum Metal coinless.jpg Lingot aluminium.jpg Eros-piccadilly-circus.jpg Production alu primaire.png President Lula visit to Aluminum factory.jpg Hydroxid hlinitý - Al(OH)3 एल्मुनियम से बना सन् १९२० का जर्मन सिक्कासन्दर्भसंपादित करें↑ title=धातु और अधातु| publication=NCERT, Class Tenth, Hindi Edition, |page=209Last edited 3 year ago By समाजसेवी वनिता कासनियां पंजाबRELATED PAGESफिटकरीकुरुविंद (कृत्रिम)अमोनियमसामग्री BAL Vnita mahila ashramके अधीन है जब तक अलग से उल्लेख ना किया गया हो।गोपनीयता नीति उपयोग की शर्तेंडेस्कटॉप
| एल्युमिनियम / Aluminium रासायनिक तत्व | |
| रासायनिक चिन्ह: | Al |
| परमाणु संख्या: | 13 |
| रासायनिक शृंखला: | संक्रमणोपरांत धातु |
 | |
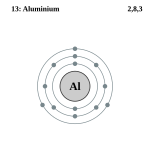
| अन्य भाषाओं में नाम: | Aluminium (अंग्रेज़ी) |
एलुमिनियम एक रासायनिक तत्व है जो धातुरूप में पाया जाता है। यह भूपर्पटी में सबसे अधिक मात्रा में पाई जाने वाली धातु है। एलुमिनियम का एक प्रमुख अयस्क है - बॉक्साईट। यह मुख्य रूप से अलुमिनियम ऑक्साईड, आयरन आक्साईड तथा कुछ अन्य अशुद्धियों से मिलकर बना होता है। बेयर प्रक्रम द्वारा इन अशुद्धियों को दूर कर दिया जाता है जिससे सिर्फ़ अलुमिना (Al2O3) बच जाता है। एलुमिना से विद्युत अपघटन द्वारा शुद्ध एलुमिनियम प्राप्त होता है।
एलुमिनियम धातु विद्युत तथा ऊष्मा का चालक तथा काफ़ी हल्की होती है। इसके कारण इसका उपयोग हवाई जहाज के पुर्जों को बनाने में किया जाता है। भारत में जम्मू कश्मीर, मुंबई, कोल्हापुर, जबलपुर, रांची, सोनभद्र, बालाघाट तथा कटनी में बॉक्साईट के विशाल भंडार पाए जाते है। उड़ीसा स्थित नाल्को (NALCO) दुनिया की सबसे सस्ती अलुमिनियम बनाने वाली कम्पनी है[1]।
इतिहाससंपादित करें
ऐल्यूमिनियम श्वेत रंग की एक धातु है। लैटिन भाषा के शब्द ऐल्यूमेन और अंग्रेजी के शब्द ऐलम का अर्थ फिटकरी है। इस फिटकरी में से जो धातु पृथक की जा सकी, उसका नाम ऐल्यूमिनियम पड़ा। फिटकिरी से तो हमारा परिचय बहुत पुराना है। कांक्षी, तुवरी और सौराष्ट्रज इसके पुराने नाम है। फिटकरी वस्तुत: पोटैसियम सल्फ़ेट और ऐल्यूमिनियम सल्फ़ेट इन दोनों का द्विगुण यौगिक है।
सन् 1754 में मारग्राफ़ (Marggraf) ने यह प्रदर्शित किया कि जिस मिट्टी को ऐल्यूमिना कहा जाता है, वह चूने से भिन्न है। सर हंफ्री डेवी ने सन् 1807 ही में ऐल्यूमिया मिट्टी से धातु पृथक करने का प्रयत्न किया, परंतु सफलता न मिली। सन् 1825 में अर्स्टेड (Oersted) ने ऐल्युमिनियम क्लोराइड को पोटैसियम संरस के साथ गरम किया और फिर आसवन करके पारे को उड़ा दिया। ऐसा करने पर जो चूर्ण सा बच रहा उसमें धातु की चमक (धात्वाभा) थी। यही धातु ऐल्युमिनियम कहलाई। सन् 1845 में फ़्रेडरिक वोहलर (Frederik Wohler) ने इस धातु के तैयार करने में पोटैसियम धातु का प्रयोग अपचायक के रूप में किया। उसे इस धातु के कुछ छोटे-छोटे कण मिले, जिनकी परीक्षा करके उसने बताया कि यह नई धातु बहुत हल्की है (आपेक्षिक घनत्व 2.5-2.7) और इसके तार खींचे जा सकते हैं। तदनंतर सोडियम और सोडियम ऐल्यूमिनियम क्लोराइड का प्रयोग करके सन् 1854 में डेविल (Deville) ने इस धातु की अच्छी मात्रा तैयार की। उस समय नई धातु होने के कारण ऐल्यूमिनियम की गिनती बहुमूल्य धातुओं में की जाती थी और इसका उपयोग आभरणों और अलंकारों में होता था। सन् 1886 में ओहायो (अमरीका) नगर में चाल्र्स मार्टिन हॉल ने गले हुए क्रायोलाइट में ऐल्यूमिना घोला और उसमें से विद्युद्विश्लेषण विधि द्वारा ऐल्यूमिनियम धातु पृथक की। यूरोप में भी लगभग इसी वर्ष हेरो (Heroult) ने स्वतंत्र रूप से इसी प्रकार यह धातु तैयार की। यही हॉल-हेरो-विधि आजकल इस धातु के उत्पादन में व्यवहृत हो रही है। हलकी और सस्ती होने के कारण ऐल्यूमिनियम और उससे बनी मिश्र धातुओं का प्रचलन तब से बराबर बढ़ता चला जा रहा है।
ऐल्यूमिनियम का निष्कर्षणसंपादित करें
ऐल्यूमिनियम धातु तैयार करने के लिए दो खनिजों का विशेष उपयोग होता है। एक तो बौक्सॉइट (Al2 O3. 2H2O) और दूसरा क्रायोलाइट (3NaF. Al F3)। बौक्साइट के विस्तृत निक्षेप भारत में राँची, पलामू, जबलपुर, बालाघाट, सेलम, बेलगाम, कोल्हापुर, थाना आदि जिलों में पाए गए हैं। इस देश में इस खनिज की अनुमित मात्रा 2.8 करोड़ टन है।
ऐल्यूमिनियम धातु तैयार करने के निर्मित्त पहला प्रयत्न यह किया जाता है कि बौक्साइट से शुद्ध ऐल्यूमिना मिले। बौक्साइट के शोधन की एक विधि, बायर (Baeyer) विधि के नाम पर प्रचलित है। इसमें बौक्साइट को गरम कास्टिक सोडा के विलयन के साथ आभिकृत करके सोडियम ऐल्यूमिनेट बना लेते हैं। इस ऐल्यूमिनेट के विलयन को छान लेते हैं और इसमें से फिर ऐल्यूमिना का अवक्षेपण कर लिया जाता है। (अवक्षेपण के निर्मित विलयन में ऐल्यूमिना ट्राइहाइड्रेट के बीजों का वपन कर दिया जाता है, जिससे सब ऐल्यूमिना अवक्षेपित हो जाता है)।
ऐल्यूमिना से ऐल्यूमिनियम धातु हॉल-हेरो-विधि द्वारा तैयार की जाती है। विद्युद्विश्लेषण के लिए जिस सेल का प्रयोग किया जाता है वह इस्पात का बना एक बड़ा बक्सा होता है, जिसके भीतर कार्बन का अस्तर लगा रहता है। कार्बन का यह अस्तर कोक, पिच और तारकोल के मिश्रण को तपाकर तैयार किया जाता है। इसी प्रकार कार्बन के धनाग्र भी तैयार किए जाते हैं। ये बहुधा 12-20 इंच लंबे आयताकार होते हैं। ये धनाग्र एक संवाहक दंड (बस बार) से लटकते रहते हैं और इच्छानुसार ऊपर नीचे किए जा सकते हैं। विद्युत् सेल के भीतर गला हुआ क्रायोलाइट लेते हैं और विद्युद्धारा इस प्रकार नियंत्रित करते रहते हैं कि उसके प्रवाह की गरमी से ही क्रायोलाइट बराबर गलित अवस्था में बना रहे। विद्युद्विश्लेषण होने पर जो ऐल्यूमिनियम धातु बनती है वह क्रायोलाइट से भारी होती है, अत: सेल में नीचे बैठ जाती है। यह धातु ही ऋणाग्र का काम करती है। गली हुई धातु समय-समय पर सेल में से बाहर बहा ली जाती है। सेल में बीच-बीच में आवश्यकतानुसार और ऐल्यूमिना मिलाते जाते हैं। क्रायोलाइट के गलनांक को कम करने के लिए इसमें बहुधा थोड़ा सा कैल्सियम फ़्लोराइड भी मिला देते हैं। यह उल्लेखनीय है कि ऐल्यूमिनियम धातु के कारखाने की सफलता सस्ती बिजली के ऊपर निर्भर है। 20,000 से 50,000 ऐंपीयर तक की धारा का उपयोग व्यापारिक विधियों में किया जाता रहा है।
एलुमिनियम के गुणसंपादित करें
व्यवहार में काम आनेवाली धातु में 99% 99.3% ऐल्यूमिनियम होता है। शुद्ध धातु का रंग श्वेत होता है, पर बाजार में बिकनेवाले ऐल्यूमिनियम में कुछ लोह और सिलिकन मिला होने के कारण हलकी सी नीली आभा होती है।
भौतिक गुणसंपादित करें
परमाणुभार : 26.97
आपेक्षिक उष्मा (20रू सें. पर) : 0.214
आपेक्षिक उष्मा चालकता (कलरी प्रति सें.मी. घन, प्रति डिग्री सें., प्रति सैकंड, 18डिग्री सें. पर) : 0.504
गलनांक (99.97% शुद्धता) : 659.8रू
क्वथनांक : 1800 डिग्री
गलन की गुप्त उष्मा : 95.3
आपेक्षिक घनत्व : 2.703
गलनांक पर द्रव का घनत्व : 2.382
विद्युत् प्रतिरोध, 20 डिग्री सें. पर : 2.845 (माइक्रोम प्रति सें.मी.घन)
विद्युत् रासायनिक तुल्यांक : 0.00009316 ग्राम प्रति कूलंब
परावर्तनता (श्वेत प्रकाश के लिए) : 85%
ठोस होने पर संकोच : 6.6%
विद्युदग्र विभव (विलयन में 25 डिग्री पर) 1.69 वोल्ट
रासायनिक गुणसंपादित करें
ऐल्यूमिनियम पर साधारण ताप पर ऑक्सिजन का कुछ भी प्रभाव नहीं पड़ता, परंतु यदि धातु के चूर्ण को 400 डिग्री ताप पर ऑक्सिजन के संपर्क में लाया जाए, तो पर्याप्त अपचयन होता है। अति शुद्ध धातु पर पानी का भी प्रभाव नहीं पड़ता, पर ताँबा, पीतल अथवा अन्य धातुओं की समुपस्थिति में पानी का प्रभाव भी पर्याप्त होता है। कार्बन अथवा कार्बन के ऑक्साइड ऊँचे ताप पर धातु को कार्बाइड (Al4 C3) में परिणत कर देते हैं। पारा और नमी की विद्यमानता में धातु हाइड्राक्साइड बन जाती है। यदि ऐल्यूमिनियम चूर्ण और सोडियम पराक्साइड के मिश्रण पर पानी की कुछ ही बूँदें पड़ें, तो जोर का विस्फोट होगा। ऐल्यूमिनियम चूर्ण और पोटैसियम परमैंगनेट का मिश्रण जलते समय प्रचंड दीप्ति देता है। धातु का चूर्ण गरम करने पर हैलोजन और नाइट्रोजन के साथ भी जलने लगता है और ऐल्यूमिनियम हैलाइड और नाइट्राइड बनते हैं। शुष्क ईथर में बने ब्रोमीन और आयोडीन के विलयन के साथ भी यह धातु उग्रता से अभिक्रिया करके ब्रोमाइड और आयोडाइड बनाती है। गंधक, सेलीनियम और टेल्यूरियम गरम किए जाने पर ही इस धातु के साथ संयुक्त होते हैं। हाइड्रोक्लोरिक अम्ल गरम होने पर धातु के साथ अभिक्रिया करके क्लोराइड बनाता है। यह क्रिया धातु की शुद्धता और अम्ल की सांद्रता पर निर्भर है। तनु सल्फ़्यूरिक अम्ल का धातु पर धीरे-धीरे ही प्रभाव पड़ता है, पर अम्ल की सांद्रता बढ़ाने पर यह प्रभाव पहले तो बढ़ता है, पर फिर कम होने लगता है। 98% सल्फ़्यूरिक अम्ल का धातु पर बहुत ही कम प्रभाव पड़ता है। नाइट्रिक अम्ल का प्रभाव इस धातु पर इतना कम होता है कि सांद्र नाइट्रिक अम्ल ऐल्यूमिनियम के बने पात्रों में बंद करके दूर-दूर तक भेजा जा सकता है। अमोनिया का विलयन कम ताप पर तो धातु पर प्रभाव नहीं डालता, परंतु गरम करने पर अभिक्रिया तीव्रता से होती है। कास्टिक सोडा, कास्टिक पोटाश और बेराइटा का ऐल्यूमिनियम धातु पर प्रभाव तीव्रता से होता है, परंतु कैल्सियम हाइड्राक्साइड का अधिक नहीं होता।
ऐल्यूमिनियम ऑक्सिजन के प्रति अधिक क्रियाशील है। इस गुण के कारण अनेक आक्साइडों के अपचयन में इस धातु का प्रयोग किया जाता है। गोल्डश्मिट की थर्माइट या तापन विधि में ऐल्यूमिनियम चूर्ण का प्रयोग करके लौह, मैंगनीज़, क्रोमियम, मालिबडीनम, टंग्सटन आदि धातुएँ अपने आक्साइडों में से पृथक की जाती हैं।
ऐल्यूमिनियम को संक्षारण से बचानासंपादित करें
बेंगफ (Bengough) और सटन ने 1926 ई. में एक विधि निकाली जिसके द्वारा ऐल्यूमिनियम धातु पर उसके आक्साइड का एक पटल इस दृढ़ता से बन जाता है कि उसके नीचे की धातु संक्षारण से बची रहे। यह कार्य विद्युद्धारा की सहायता से किया जाता है। ऐल्यूमिनियम पात्र को धनाग्र बनाकर 3 प्रतिशत क्रोमिक अम्ल के विलयन में (जो यथासंभव सल्फ़्यूरिक अम्ल से मुक्त हो) रखते हैं। वोल्टता धीरे-धीरे 40 वोल्ट तक 15 मिनट के भीतर बढ़ा दी जाती है। 35 मिनट तक इसी वोल्टता पर क्रिया होने देते हैं, फिर वोल्टता 5 मिनट के भीतर 50 वोल्ट कर देते हैं और 5 मिनट तक इसे स्थिर रखते हैं। ऐसा करने पर पात्र पर आक्साइड का एक सूक्ष्म पटल जम जाता है। पात्र पर रंग या वार्निश भी चढ़ाई जा सकती है और यथेष्ट अनेक रंग भी दिए जा सकते हैं। इस विधि को एनोडाइज़िंग या धनाग्रीकरण कहते हैं और इस विधि द्वारा बनाए गए सुंदर रंगों से अलंकृत ऐल्यूमिनियम पात्र बाजार में बहुत बिकने को आते हैं।
ऐल्यूमिनियम मिश्रधातुएँसंपादित करें
ऐल्यूमिनियम लगभग सभी धातुओं के साथ संयुक्त होकर मिश्र धातुएँ बनाता है, जिनमें से तॉबा, लोहा, जस्ता, मैंगनीज़, मैगनीशियम, निकेल, क्रोमियम, सीसा, बिसमथ और वैनेडियम मुख्य हैं। ये मिश्रधातुएँ दो प्रकार के काम की हैं – पिटवाँ और ढलवाँ। पिटवाँ मिश्रधातुओं से प्लेट, छड़ें आदि तैयार की जाती हैं। इनकी भी दो जातियाँ हैं, एक तो वे जो बिना गरम किए ही पीटकर यथेच्छ अवस्था में लाई जा सकती हैं, दूसरी वे जिन्हें गरम करना पड़ता है। पिटवाँ और ढलवाँ मिश्रधातुओं के दो नमूने यहाँ दिए जाते हैं-
ढलवाँ : ताँबा 8%, लोहा 1%, सिलिकन 1.2%, ऐल्यूमिनियम 89.8% पिटवाँ : ताँबा 0.9%, सिलिकन 12.5%, मैगनीशियम 1.0 %, निकेल 0.9%, ऐल्यूमिनियम 84.7%
ऐल्यूमिनियम के यौगिकसंपादित करें
ऐल्यूमिनियम ऑक्साइड (Al2 O3) प्रकृति में भी पाया जाता है तथा फिटकरी और अमोनिया क्षार की अभिक्रिया से तैयार भी किया जा सकता है। इसमें जल की मात्रा संयुक्त रहती है। जलरहित ऐल्यूमिनियम क्लोराइड (AlCl3) का उपयोग कार्बनिक रसायन की फ़्रीडेन-क्राफ़्ट अभिक्रिया में अनेक संश्लेषणों में किया जाता है। ऐल्यूमिनियम सलफ़ेट के साथ अनेक फिटकरियाँ बनती हैं। धातु को नाइट्रोजन या अमोनिया के साथ 800 डिग्री से. ताप पर गरम करके ऐल्यूमिनियम नाइट्राइड, (AlN), तैयार किया जा सकता है। सरपेक (Serpek) विधि में ऐल्यूमिना और कार्बन को नाइट्रोजन के प्रवाह में गरम करके यह नाइट्राइड तैयार करते थे। इस प्रकार वायु के नाइट्रोजन का स्थिरीकरण संभव था। बौक्साइट और कार्बन को बिजली की भट्टियों में गलाकर ऐल्यूमिनियम कार्बाइड (Al4 C3) तैयार करते हैं, जो संक्षारण से बचाने में बहुत काम आता है और ऊँचा ताप सहन कर सकता है।
ऐल्युमिनियम त्रिसंयोजी तत्व है अत: इसके यौगिकों में +3 की संयोजकता, Al(III), प्रदर्शित होती है। इसके प्रमुख यौगिक आक्साइड, क्लोराइड, नाइट्रेट, सल्फेट तथा हाइड्राक्साइड हैं।
ऐल्युमिनियम आक्साइड (Al2O3)- इसे ऐल्युमिना भी कहते हैं। यह ऐल्युमिनियम का श्वेत या रंगहीन आक्साइड है जो दो रूपों में पाया जाता है-स्थायी रूप अथवा अ-रूप जिसके क्रिस्टल षटभुजी होते हैं तथा गामा ऐल्युमिना (य्) जो गर्म करने पर अ-रूप में बदल जाता है। इनके अतिरिक्त भ्.8 आदि रूप भी ज्ञात हैं जिनमें क्षारीय धातु आयन रहते हैं।
ऐल्युमिना प्रकृति में बाक्साइट तथा कोरंडम के रूप में पाया जाता है। इसे ऐल्युमिनियम हाइड्राक्साइड, नाइट्रेट अथवा अमोनियम फिटकरी को गर्म करके प्राप्त किया जा सकता है।
2 Al (OH)3 --> Al2O3+3H2O
4 Al (NO3)2 --> Al2O3+ 8NO2+3O2
(NH4)2 SO4.Al2(SO4)3 --> Al2O3+4SO3+2NH3-H2O
शुद्ध ऐल्युमिनियम आक्साइड प्राप्त करने के लिए बाक्साइट अयस्क को सोडियम हाइड्राक्साइड में घोलते हैं। जो अशुद्धियाँ होती हैं वे अविलेय रही आती हैं। ऐल्युमिनियम हाइड्राक्साइड अवक्षेप को विलग करके 1150-1200 तक गर्म करने पर अ_ आक्साइड बनाता है। यह अत्यधिक कठोर पदार्थ है अत: अपघर्षक के रूप में प्रयुक्त किया जाता है। इसकी अग्निसह ईंटें भी बनाई जाती हैं। भट्टियों में दुर्गलनीय अस्तर बनाने के भी काम आता है।
ऐल्युमिनियम आक्साइड उभयधर्मी है अत: अम्लो तथा क्षारों में समान रूप से विलयित होकर लवण उत्पन्न करता है। क्षारों के साथ ऐल्युमिनेट बनता है।
Al2O3+6HCl --> 2AlCl3-3H2O
Al2O3+2NaOH-2NaAlO2+H2O
हाइड्रोजन अथवा कार्बन के साथ गर्म करने पर Al2O3 अपचित नहीं होता.
ऐल्युमिनियम ऐसीटेट अथवा ऐथेनोएट- यह श्वेत ठोस है जो ठंडे जलमें बहुत कम विलेय है और गर्म जल में विघटित हो जाता है। जल की अनुपस्थित में शुद्ध लवण बन सकता है। अन्यथा क्षारीय लवण ही बनता है। इसका उपयोग रंगबन्धक के रूपमें तथा टैंनिग में किया जाता है। पहले संक्रमणरोधी तथा औषधि के रूप में प्रयुक्त होता था।
ऐल्युमिनियम क्लोराइड (AlCl3)- यह श्वेत ठोस है और जल के साथ तीव्रता से क्रिया करके HCl बनाता है। यह दो रूपों में पाया जाता है- (1) निर्जल रूप तथा (2) जलयोजित हेक्साहाइड्रेट AlHCl3.6H2O. प्रयोगशाला में ऐल्युमिनियम के ऊपर क्लोरीन गैस प्रवाहित करके निजल क्लोराइड प्राप्त करते हैं-
2Al +3HCl2 -2AlHCl3
किन्तु बहुत मात्रा में उत्पादक के लिए गरम किये गये ऐल्युमिना तथा कार्बन मिश्रण के ऊपर क्लोरीन प्रवाहित करते हैं-
जलयोजित क्लोराइड प्राप्त करने के लिए ऐल्युमिनियम धातु या ऐल्युमिना को हाइड्रोक्लोरिक अम्ल में विलयित करके विलयन को सुखाकर किया जाता है-
2Al+6H --> HCl + H2
यदि जलयोजित क्लोराइड को गर्म करके निर्जल लवण बनाना चाहें तो यह सम्भव नहीं है क्योंकि तब ऐल्युमिना बनता है-
2 AlHCl3. 6H2O --> Al2O H2O + 6HHCl
द्रव तथा वाष्प अवस्था में समान रूप Al2HCl6 पाया जाता है। ऐल्युमिनियक्लोराइड का जल अपघटन होता है अत: HHCl डालकर रखना चाहिए. इसका उपयोग तेलों के भंडारों में उत्प्रेरक के रूप में होता है। फ्रीडल-क्रैफ्ट अभिक्रियां भी उत्प्रेरक का कार्य करती हैं।
ऐल्युमिनियम ट्राइमेथिल (Al3H2O3) यह रंगहीन द्रव्य है जो वायु में जल उठता है और जल के साथ अभिक्रिया करके मेथेन तथा Al(OH)3 बनाता है। इसे AlHCl3 के साथ ग्रिग्न्याँ अभिकर्मक की क्रिया द्वारा तैयार करते हैं। इसका उपयोग उच्च घनत्व वाले पालीथीन बनाने में होता है।
ऐल्युमिनियम नाइट्रेट Al(NO)3 यह श्वेत ठोस है। इस तुरन्त अवक्षेपित Al(OH)3 में से HNO3 की क्रिया कराकर या फिर Al2(SO4)3 एवं (NO3)2 विलयनों को मिलाकर PbSO4 अवक्षेप को छानकर प्राप्त कर सकते हैं। इसका उपयोग रँगाई तथा गैस गैटल बनाने में होता है।
ऐल्युमिनियम पोटैसियम सल्फेट Al2(SO4)3.K2SO4. 24 H2O- यह पोटाश ऐलम या ऐलग (फिटकरी) के नाम से प्रसिद्ध है। यह श्वेत क्रिस्टलीय यौगिक है जिसे गर्म करने पर पहले 18 H2O निकल जाता है और अधिक गर्म करने पर (200) निर्जल बन जाता है। यह गर्म जल में विलेय है किन्तु एथेनाल तथा ऐसीटोन में अविलेय है। इसे तैयार करने के लिए पोटैसियम सल्फेट तथा ऐल्युमिनियम सल्फेट की समआणविक मात्राएँ विलयन रूप में मिलाई जाती है। इसका उपयोग रंगबन्धक, चमड़ा कमाने तथा अग्निशामक में होता है।
ऐल्युमिनियम फ्लोराइड AlF- यह रंगहीन यौगिक है जिसे Al (OH)2 के ऊपर HF की क्रिया कराकर बनाते हैं। इस पर अम्लों या क्षारों की कोई क्रिया नहीं होती.
ऐल्युमिनियम सल्फेट- यह निर्जल तथा जलयोजित रूपों में प्राप्त होता है। Al2(SO4)3 निर्जल रूप है जो श्वेत क्रिस्टलीय यौगिक है। जलयोजित यौगिक Al2(SO4) 18 H2O है जो 86.5 पर अपना जल खो देता है। जलयोजित तथा निर्जल दोनों ही रूप में जल विलेय हैं। जब Al(OH)3 के साथ H2SO4 की क्रिया कराई जाती है या चीनी मिट्टी (केओलिन) या बाक्साइट पर H2SO4 की क्रिया कराते हैं जो जलयोजित सल्फेट बनता है। इसका जलीय विलयन अम्लीय होता है-
Al2 (SO4)3 + 6H2O --> 2Al(OH)3 + 3H2SO4 यह क्षारीय धातु सल्फेटों के साथ फिटकरी बनाता है। गर्म करने पर इसका अपघटन हो जाता है-
Al2(SO4)3 --> Al2O3 +3SO
इसका उपयोग पानी के शोधन, विशेषतया मल-जल के परिष्कार, कपड़ो की रँगाई, चमड़े की रँगाई तथा कागज उद्योग में होता है। इससे अग्निसह पदार्थ बनाये जाते है।
ऐल्युमिनियम सिलेकेट- प्राकृतिक तथा सश्लिष्ट दोनों प्रकार के यौगिक, जिनमें Al.Si के साथ आक्सीजन संयुक्त रहता है। मृत्तिकाएँ, जेयोलाइट, अभ्रक आदि मुख्य उदाहरण हैं।
ऐल्युमिनियम हाइड्राक्साइड Al(OH)3- यह उभयधर्मी हाइड्राक्साइड है जो अम्लों तथा क्षारों में समान रूप सें विलयित हो जाता है। यह श्वेत जिलेटिनी ठोस है जिसे ऐल्युमिनियम लवणों के विलयन में अमो_निया डालकर तैयार किया जा सकता है। यह गर्म किये जाने पर ऐल्युमिना में परिणत हो जाता है।
2Al(OH)3 --> Al2O3 + 3H2O
इसमें उपसहसंयोजित जल अणु होते हैं अत: जलयोजित Al(OH)3 कहलाता है। इसका उपयोग जल परिष्करण, रंगबंधक तथा जलसह वस्त्र बनाने में होता है। उत्प्रेरक तथा क्रोमैटोग्राफी में भी प्रयुक्त.
चित्रसंपादित करें
Hydroxid hlinitý - Al(OH)3
एल्मुनियम से बना सन् १९२० का जर्मन सिक्का
सन्दर्भसंपादित करें
- ↑ title=धातु और अधातु| publication=NCERT, Class Tenth, Hindi Edition, |page=209







Comments